来源:DeepTech深科技
继双螺旋之后,G-四链体(G-Quadruplexes, G4s)被认为是至关重要的非经典 DNA 或 RNA 二级结构。
多年来,G4s 已被证明在多种生物过程中具有重要的调节作用。与 DNA G4s(dG4s)相比,RNA G4s(rG4s)的研究直到近年来才逐渐受到关注。
rG4s 由富含鸟嘌呤的多个 G-四分体(G-tetrads)组装,每个 G-四联体由四个鸟嘌呤以环状 Hoogsteen 氢键和中心阳离子(如 K+)配位稳定的平面排列而成。
rG4s 发挥着重要的基因组调控功能,例如端粒维持、mRNA 转录后调控和非编码 RNA 成熟加工等,已经成为研究核酸二级结构如何影响细胞过程的焦点。
rG4s 的形成一直被科学家们视为一种动态和短暂的行为,因此,开发用于检测和调控活细胞中 rG4s 的工具仍然具有挑战性。
近年来,香港城市大学郭骏杰副教授团队率先开发了 rG4-SELEX 和 G4-SELEX-seq,用于筛选一系列非天然的 L-RNA 适配体,靶向功能性rG4s[1-6],并且被 rG4 和核酸领域高度认可。
郭骏杰表示,L-RNA 作为非天然核酸,由于具有很强的核酸酶抗性和生物稳定性,可以通过非碱基互补配对作用的特异性,来识别目标 rG4s。
但是值得关注的是,L-RNA 适体穿透细胞膜的能力较差,进入细胞往往需要通过脂质体转染,这极大地限制了它在生物学领域的应用。因此,迫切需要开发出一种有效和通用的方法,以提高细胞对 L-RNA 适配体的摄取。
(来源:Angewandte International Edition Chemie)
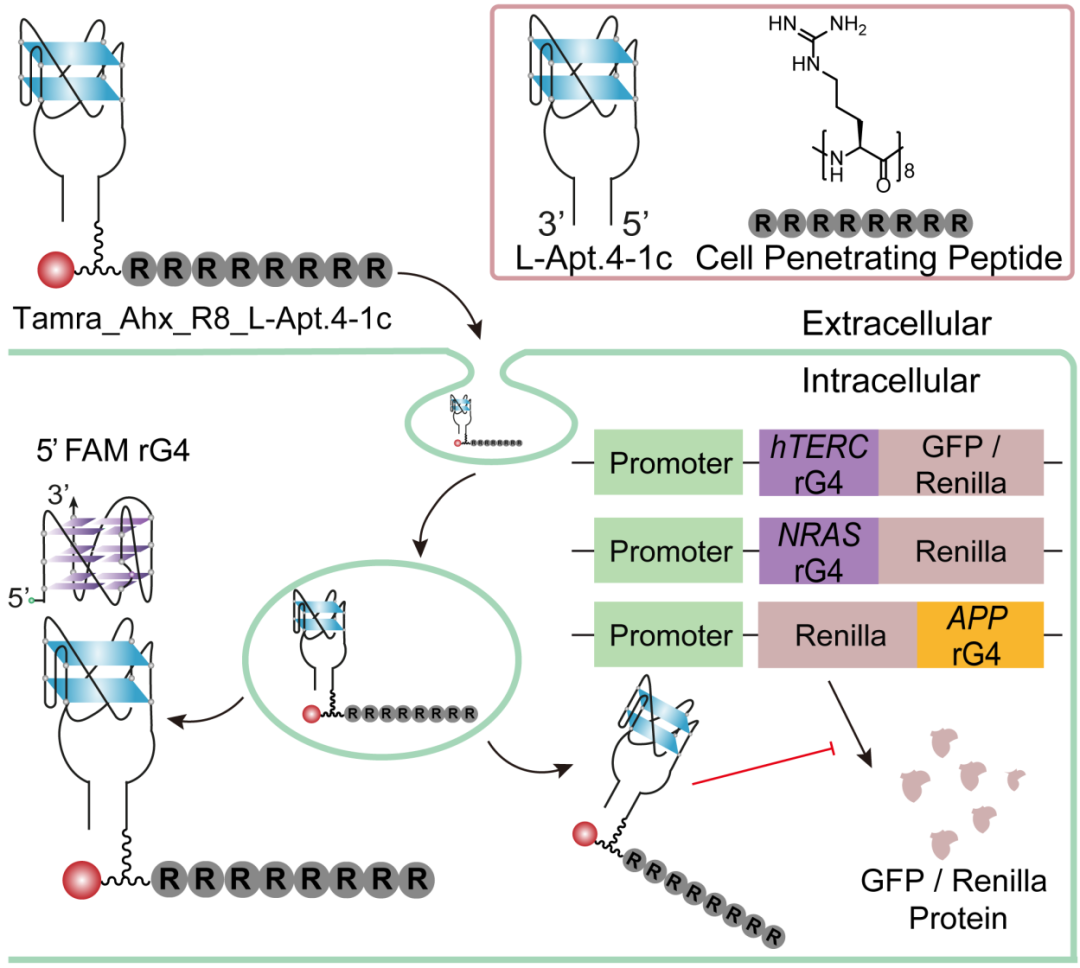
近期,郭骏杰课题组在 Angewandte International Edition Chemie 报道了一种使用细胞穿膜肽将靶向 rG4s 的 L-RNA 适体转运到细胞质中的新策略[7]。
通过点击化学将多聚精氨酸残基共价连接到 L-RNA 适体上,并产生了第一个 L-RNA 适体-肽偶联物(Tamra_Ahx_R8_L-Apt.4-1c)。
在该研究中,通过高效偶联 L-RNA 适体和穿膜肽的点击反应,该偶联物使 L-RNA 适体在提高细胞内化效率的同时,保留了与目标 rG4 的亲和力及特异性。
并且,由此进一步证明了 L-RNA 适体-穿膜肽偶联物能够有效抑制 5’UTR和 3’UTR 上 rG4 介导的翻译,从而实现了基因调控。该研究表明,Tamra_Ahx_R8_L-Apt.4-1c 是调节 rG4 介导的基因表达的有效工具。
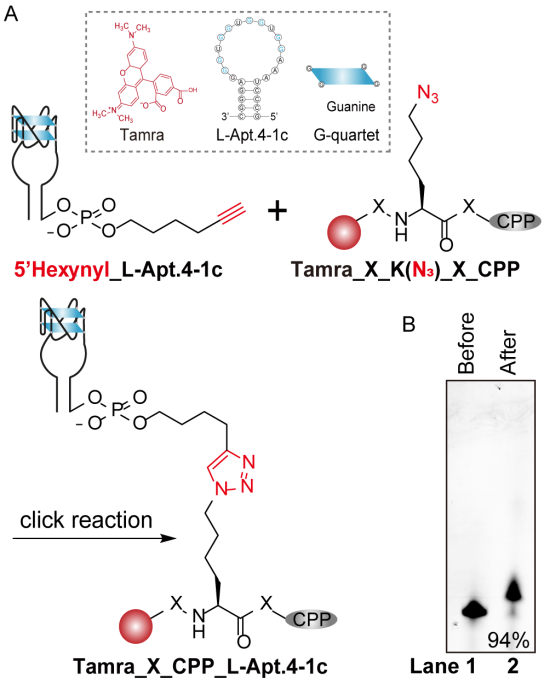
图丨点击反应展示 L-RNA 适体与穿膜肽的偶联及产率(来源:Angewandte International Edition Chemie)
与以往研究相比,这项研究的主要优势体现在以下三方面:
第一,利用点击化学开发了一种高效偶联 L-RNA 适体和穿膜肽的方法,偶联效率高达 94%。
第二,通过优化穿膜肽序列和连接子长度,筛选出 L-RNA 适体-肽偶联物 Tamra_Ahx_R8_L-Apt.4-1c,该偶联物的细胞内化效率极大提升,并特异靶向目标 rG4 序列。
第三,展示了 Tamra_Ahx_R8_L-Apt.4-1c 能够结合 mRNA 上不同区域 rG4 基序,并实现基因调控。
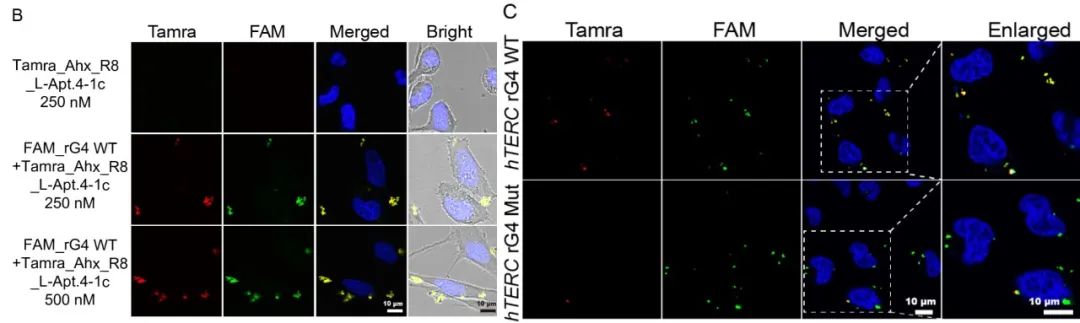
图丨Tamra_Ahx_R8_L-Apt.4-1c 能够有效内化进细胞并与 hTERCD-rG4 结合(来源:Angewandte International Edition Chemie)
具有潜在生物医学用途的新型功能性核酸,是当今化学生物学领域的前沿和热点。与小分子探针、抗体等传统的 rG4 识别试剂相比,L-RNA 适配体具有生物稳定性好、特异性强、易于进行化学和生物修饰的优势。
该论文第一作者、香港城市大学博士后张坤表示:“我们探索了提高 L-RNA 适体的细胞摄取效率的方法,有望成为继抗体和小分子后,第三类高效靶向和调控 rG4 的工具。”
审稿人对该研究评价称,这是一项重要的开发新型功能性 RNA 适体缀合物的系统和基础研究,促进了新型功能性核酸的潜在生物医学用途,对推动基于核酸的治疗领域具有重要的意义,会引起化学、生物学和医学领域研究人员的极大兴趣。

郭骏杰课题组长期从事核酸化学和生物学研究。他们致力于研究 RNA 结构和相互作用在生物学中的作用,用于检测、成像、干扰 RNA 结构和相互作用的靶向工具的开发, 以及感知化学污染物和病原体的新技术。
主要包括 G-四链体结构/相互作用、RNA 生物学和基因调控以及适配体开发与应用等。下一步,该课题组将继续优化设计 L-RNA 适体的递送体系,提高亲和力和特异性,并致力于在动物实验方面有所突破。

参考资料:
1.Chan, C. Y. & +Kwok, C. K. Specific Binding of a D-RNA G-Quadruplex Structure with an L-RNA Aptamer.Angewandte Chemie International Edition 59, 5293 –5297 (2020). https://doi.org/10.1002/ani.201914955
2.Ji, D., Lyu, K., Zhao, H. & +Kwok, C.K. Circular L-RNA aptamer promotes target recognition and controls gene activity. Nucleic Acids Research49, 7280-7291 (2021). https: //doi.org/10.1093/nar/gkab593
3.Mou, X., Liew, S. W. & +Kwok, C.K. Identification and targeting of G-quadruplex structures in MALAT1 long non-coding RNA. Nucleic Acids Research 50, 397- 410 (2022). https: //doi.org/10.1093/nar/gkab1208
4.2022Umar, M.I., Chan, CY. & +Kwok, C.K. Development of RNA G-quadruplex (rG4)-targeting L-RNA aptamers by rG4-SELEX. Nature Protocols 17, 1385-1414 (2022). https://doi.org/10.1038/s41596-022-00679-6
5.Zhao, H., Wong, H.Y., Ji, D., Lyu, K. & +Kwok, C.K. Novel L-RNA Aptamer Controls APP Gene Expression in Cells by Targeting RNA G-Quadruplex Structure.ACS Applied Materials & Interfaces 14, 30582- 30594 (2022). https://doi.org/10.1021/acsami.2c06390
6.Ji, D., Yuan, J., Chen, S., Tan, J., Kwok, C. K. Selective targeting of parallel G-quadruplex structure using L-RNA aptamer. Nucleic Acids Research 51, 11439–11452 (2023).http://doi.org/10.1093/nar/gkad900
7. Zhang, K., Nie, Q., Lau, C. K., Kwok, C. K. Rational Design of L-RNA Aptamer-Peptide Conjugate for Efficient Cell Uptake and G-quadruplex-Mediated Gene Control. Angewandte Chemie International Edition 63, e202310798 (2024). https://doi.org/10.1002/anie.202310798
运营/排版:何晨龙
新冠肺炎

 新浪科技公众号
新浪科技公众号 “掌”握科技鲜闻 (微信搜索techsina或扫描左侧二维码关注)
 相关新闻
相关新闻